- 简体中文
- English
- 繁體中文
- Deutsch
- Corsu
- guarani
- Hausa
- Cymraeg
- Nederlands
- 日本語
- गोंगेन हें नांव
- Aymara
- Français
- Kreyòl ayisyen
- čeština
- ʻŌlelo Hawaiʻi
- डोग्रिड ने दी
- Русский язык
- ภาษาไทย
- հայերեն
- فارسی
- Hmoob
- ދިވެހި
- भोजपुरी
- Türkçe
- हिंदी
- беларускі
- български
- tur
- Gaeilge
- ગુજરાતી
- Magyar
- eesti keel
- بالعربية
- বাংলা
- Azərbaycan
- Português
- Suid-Afrikaanse Dutch taal
- کوردی-سۆرانی
- Ελληνικά
- español
- Frysk
- dansk
- አማርኛ
- euskara
- Italiano
- Tiếng Việt
- 한어
- অসমীয়া
- català
- Suomalainen
- Eʋegbe
- Hrvatski
- Cebuano
- Gàidhlig na h-Alba
- bosanski
- galego
-
-
International
简体中文 English 繁體中文 Deutsch Corsu guarani Hausa Cymraeg Nederlands 日本語 गोंगेन हें नांव Aymara Français Kreyòl ayisyen čeština ʻŌlelo Hawaiʻi डोग्रिड ने दी Русский язык ภาษาไทย հայերեն فارسی Hmoob ދިވެހި भोजपुरी Türkçe हिंदी беларускі български tur Gaeilge ગુજરાતી Magyar eesti keel بالعربية বাংলা Azərbaycan Português Suid-Afrikaanse Dutch taal کوردی-سۆرانی Ελληνικά español Frysk dansk አማርኛ Bamanankan euskara Italiano Tiếng Việt 한어 অসমীয়া català Suomalainen Eʋegbe Hrvatski Cebuano Gàidhlig na h-Alba bosanski galego
AI 设计蛋白质新方法登 Science,利用强化学习,直接根据预想优化结构
发布时间:2023-04-23 14:26
现在,强化学习不仅能下围棋,还能设计蛋白质了!
RoseTTAFold 团队独创性方法,利用强化学习、自上而下设计蛋白质复合物结构,登上最新一期 Science。

利用该方法,团队设计出了上百个蛋白质结构。
经电子显微镜等观测证实,这些结构大部分都能在实验室中合成。
而且预期纳米结构和实际纳米结构之间的平均偏差小于单个原子直径,即实现了精确原子级设计。
在实际应用上,由该方法设计出的蛋白质能有效在小鼠体内产生有用抗体,并为未来开发出更有效的疫苗和药物创造可能。
因此团队表示,这是 AI 设计蛋白质领域的一个里程碑式研究,或将为蛋白质设计领域开创新时代。
作为 AI 设计蛋白质领域的明星团队,华盛顿大学 David Baker 教授曾率队开发出精度上可媲美 AlphaFold2 的蛋白质预测设计方法 RoseTTAFold。
并在实际计算中达到了更快更轻便的效果,只需要一个英伟达 RTX2080 GPU,10 分钟就能算出蛋白质结构。
先给预设再不断优化
强化学习的原理,就是通过不断地试错学习,让 agent(智能体)通过与环境进行交互获得奖赏指导行为,目标是获得最大的奖赏。
将它应用到蛋白质设计方面,科学家们为程序提供了数百万个简单的起始分子,然后让软件进行一万次尝试,随机地改善每一个预定目标。
程序将以特定方式拉长或弯曲蛋白质,直到学会如何将它们设计为所需的结构。
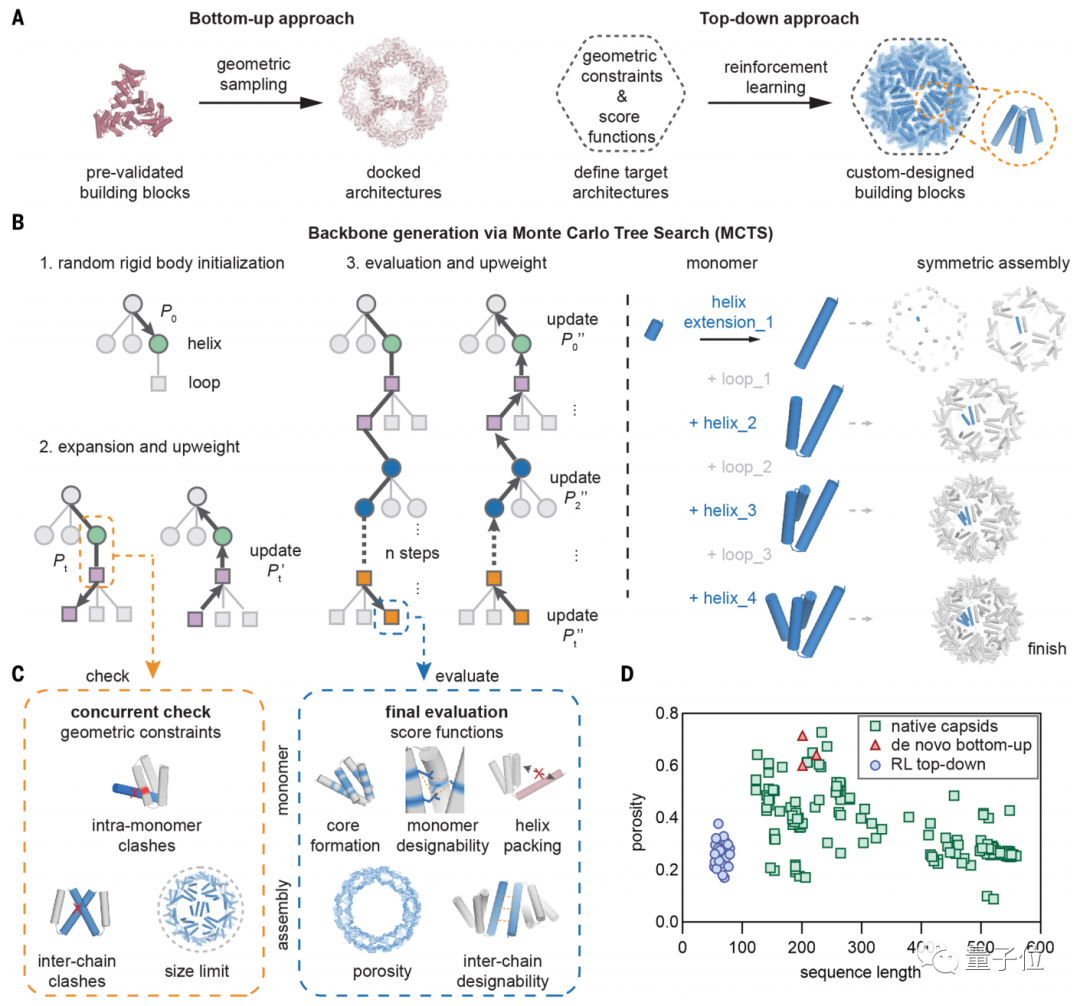
该方法先给出了先验约束和得分函数定义目标结构,然后通过强化学习不断探索,以得到定制化的构建模块。
它有别于此前自下而上的设计方法。程序将不再局限于依据已知的寡聚体原件来设计蛋白质,并能从全局角度来优化整个蛋白质结构。
然后再通过蒙特卡洛树搜索算法,确定骨干生成。
该方法能实现给出一个“游戏状态”并选择胜率最高的下一步。AlphaGo 中应用了这一原理。
在展开的每个阶段,如果出现了违规情况就中止搜索树;在模拟完成后,则通过一系列分数函数进行最终评估。
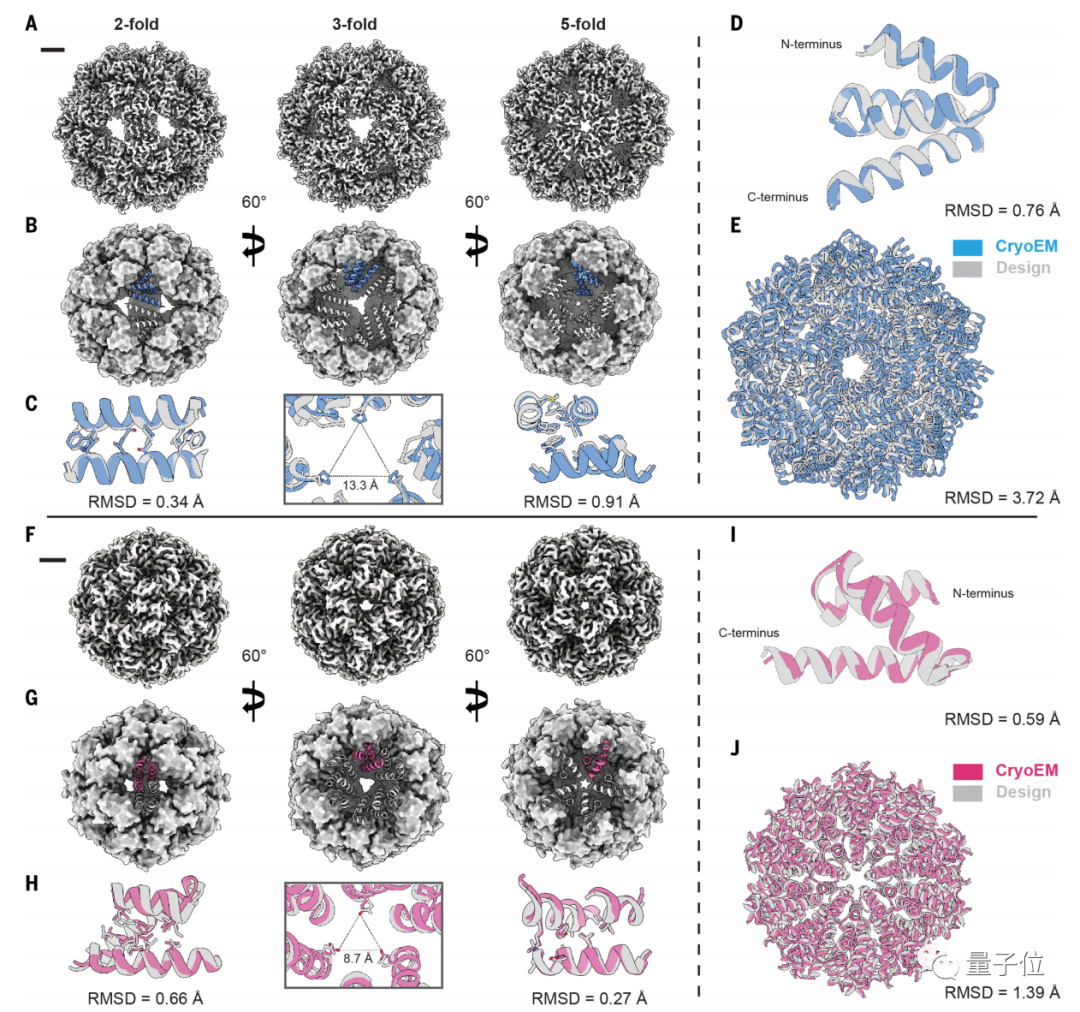
结果表明,面对传统“自下而上”方法无法构建的蛋白结构,最新方法不仅能设计结构,而且结果和冷冻电镜结构和计算机模型非常接近。
研究人员构建了数百种结构后表示,这些结构中的大多数都能在实验室中构建。
而且团队表示,这种方法不仅准确性高,还高度可定制化。
比如可以要求它设计出无孔隙、小孔或大孔不同要求的球状结构,这种能力还有待进一步挖掘。
据了解,该团队致力于设计由许多蛋白质分子组成的新型纳米级结构。这需要设计蛋白质组件,并能够让纳米结构自组装。
在由 AI 设计的结构中,每个原子都出现了预定的位置上。即预期结构和可实现纳米结构之间的平均偏差不到一个原子的直径,这也可以被称为精确原子设计。
由此团队认为,这种方法能够设计出药物、疫苗等方面的蛋白。
华盛顿大学干细胞和再生医学研究所的研究人员使用血管细胞中的原代细胞(Primary cells)模型,证明了新方法设计的蛋白质结构优于此前方法。
比如在结构上构建出了更为聚集的信号接收受体,这提升了血管的稳定性。
团队介绍
该研究来自华盛顿大学 David Baker 教授团队。

David Baker 现在是华盛顿大学蛋白质设计研究所所长。1984 年在哈佛大学本科毕业,后赴加州大学伯克利分校攻读博士学位。
他致力于研究蛋白质结构预测、设计以及蛋白质折叠机制等领域。是利用 AI 探索蛋白质结构领域的大佬级人物。
最为人熟知的工作是 RoseTTAFold。
这种蛋白质结构设计方法,不仅在精度上媲美 AlphaFold2,并且在算法上更轻便。更有意思的是,它和 AlphaFold2 同天开源,一个登 Sciecne,一个登上 Nature。
去年,该团队还提出了一种新的蛋白质设计策略,针对几乎任何感兴趣的靶点蛋白,RoseTTAFold 都能设计出与之紧密结合的蛋白质分子作为候选药物,应用可覆盖癌症、新冠等诸多疾病。
而后该团队发表在 Science 上的研究表明,机器学习可以比以前更快速和精确地构建蛋白质分子。
值得一提的是,在产业化方面 David Baker 以科学联合创始人身份,加入了英国 AI 创新药企 CHARM Therapeutics,去年该公司获得了 5 千万美元融资。









)
 工信部备案号:
工信部备案号:  公安部备案号:
公安部备案号: